I ricercatori dell’UC Santa Cruz hanno scoperto un peptide nell’RNA umano che regola l’infiammazione e potrebbe fornire un nuovo percorso per il trattamento di malattie come l’artrite e il lupus. Il team ha utilizzato un processo di screening basato sul potente strumento di editing genetico CRISPR per far luce su uno dei più grandi misteri del nostro RNA:la molecola responsabile della realizzazione delle informazioni genetiche contenute nel nostro DNA.
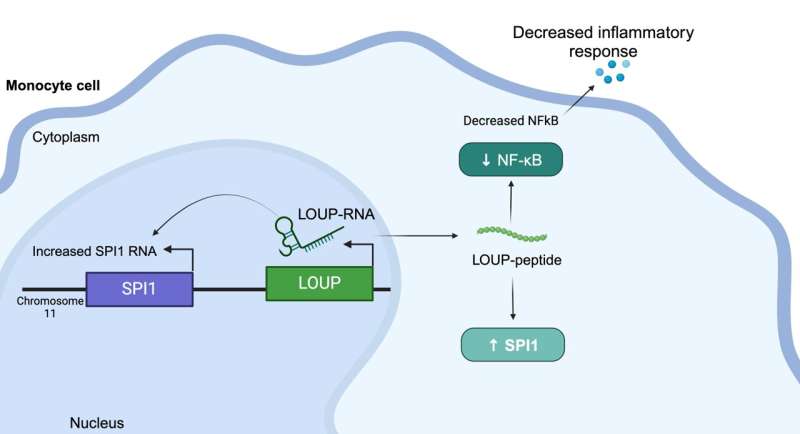
Questo peptide ha origine all'interno di un lungo RNA non codificante (lncRNA) chiamato LOUP. Secondo i ricercatori, il genoma umano codifica oltre 20.000 lncRNA, rendendolo il più grande gruppo di geni prodotti dal genoma. Ma nonostante questa abbondanza, gli scienziati sanno poco sul perché esistono gli lncRNA o su cosa fanno. Questo è il motivo per cui l'lncRNA viene talvolta definito la "materia oscura del genoma".
Lo studio, pubblicato il 23 maggio negli Proceedings of the National Academy of Sciences (PNAS), è uno dei pochissimi nella letteratura esistente a svelare i misteri dell'lncRNA. Presenta inoltre una nuova strategia per condurre uno screening ad alto rendimento per identificare rapidamente gli lncRNA funzionali nelle cellule immunitarie. L'approccio pooled-screen consente ai ricercatori di prendere di mira migliaia di geni in un singolo esperimento, il che rappresenta un modo molto più efficiente per studiare porzioni non caratterizzate del genoma rispetto agli esperimenti tradizionali che si concentrano su un gene alla volta.
La ricerca è stata condotta dall'immunologa Susan Carpenter, professoressa e presidente Sinsheimer del dipartimento di biologia molecolare, cellulare e dello sviluppo dell'UC Santa Cruz. Studia i meccanismi molecolari coinvolti nella protezione dalle infezioni. Nello specifico, si concentra sui processi che portano all'infiammazione per determinare il ruolo svolto dagli lncRNA in questi percorsi.
"L'infiammazione è una caratteristica centrale di quasi tutte le malattie", ha detto. "In questo studio, il mio laboratorio si è concentrato sul tentativo di determinare quali geni lncRNA sono coinvolti nella regolazione dell'infiammazione."
Ciò significava studiare gli lncRNA in un tipo di globuli bianchi noto come monocita. Hanno utilizzato una modifica della tecnologia CRISPR/Cas9, chiamata inibizione CRISPR (CRISPRi), per reprimere la trascrizione genetica e scoprire quale degli lncRNA di un monocita gioca un ruolo nel differenziarsi in un macrofago, un altro tipo di globuli bianchi fondamentale per una risposta immunitaria ben funzionante.
Inoltre, i ricercatori hanno utilizzato CRISPRi per individuare il coinvolgimento dell’lncRNA dei macrofagi nell’infiammazione. Inaspettatamente, hanno individuato una regione che è multifunzionale e può funzionare come un RNA, oltre a contenere un peptide non ancora scoperto che regola l'infiammazione.
Comprendere che questo specifico peptide regola l’infiammazione offre ai produttori di farmaci un obiettivo per bloccare l’interazione molecolare dietro quella risposta al fine di sopprimerla, ha detto Carpenter. "In un mondo ideale, si progetterebbe una piccola molecola per interrompere quella specifica interazione, invece di, ad esempio, prendere di mira una proteina che potrebbe essere espressa in tutto il corpo", ha spiegato. "Siamo ancora lontani dal prendere di mira questi percorsi con quel livello di precisione, ma questo è sicuramente l'obiettivo. Al momento c'è molto interesse per le terapie a base di RNA."
I coautori dello studio dell'UC Santa Cruz includono Haley Halasz, Eric Malekos, Sergio Covarrubias, Samira Yitiz, Christy Montano, Lisa Sudek e Sol Katzman, insieme a ricercatori dell'UCSF e del MIT.
Ulteriori informazioni: Haley Halasz et al, gli screening CRISPRi identificano l'lncRNA, LOUP, come un locus multifunzionale che regola la differenziazione dei macrofagi e la segnalazione infiammatoria, Atti dell'Accademia Nazionale delle Scienze (2024). DOI:10.1073/pnas.2322524121
Informazioni sul giornale: Atti dell'Accademia Nazionale delle Scienze
Fornito dall'Università della California - Santa Cruz