
Una comunicazione efficiente tra le cellule è vitale per molti processi biologici, come il reclutamento di cellule immunitarie per combattere le malattie. Il rapido rilascio di almeno 80 molecole di segnalazione, tra cui il fattore di necrosi tumorale e il fattore di crescita epidermico, è controllato da una proteasi legata alla membrana chiamata ADAM17.
Questo processo prevede la scissione (eliminazione) di ADAM17 delle molecole di segnalazione dalle loro forme precursori nella membrana di una cellula. La "pseudoproteasi" iRhom2 aiuta nella maturazione e nel trasporto di ADAM17. La mancanza di una visione strutturale, tuttavia, ha lasciato poco chiari i meccanismi alla base di questo processo.
Pubblicato oggi in Cellula molecolare , gli scienziati del St. Jude Children's Research Hospital e dell'Università di Oxford hanno utilizzato la microscopia crioelettronica per rivelare una serie di strutture del complesso umano ADAM17/iRhom2 sia nello stato attivo che inattivo. Queste strutture mostrano che iRhom2 funge da custode del ciclo di vita di ADAM17, interagendo con le regioni chiave di ADAM17 che ne controllano l'attività.
Il lavoro offre anche potenziali strade per la progettazione di farmaci per combattere le malattie di infiammazione cronica e disregolazione autoimmune. "Pensiamo che ci sia il potenziale per progettare piccole molecole che colpiscano direttamente iRhom2 anziché ADAM17, o l'interfaccia tra iRhom2 e ADAM17", ha affermato l'autore co-corrispondente, Chia-Hsueh Lee, Ph.D., Dipartimento di Biologia Strutturale di St. Jude. .
iRhom2 è una pseudoproteasi:ha tutte le caratteristiche strutturali di una proteasi della famiglia dei romboidi, tranne che non ha la capacità di definire la proteasi di scindere le proteine. Tuttavia, come un vecchio cane che impara nuovi trucchi, iRhom2 svolge ruoli nuovi nelle impalcature e nel trasporto di ADAM17.
Come hanno rivelato gli studi strutturali, l'impatto di iRhom2 sulla funzione di ADAM17 inizia durante la sintesi iniziale delle due proteine. "Il reticolo endoplasmatico è il luogo in cui vengono prodotti ADAM17 e iRhom2 e, in questa fase, formano un complesso", ha spiegato Lee. iRhom2 facilita quindi lo spostamento di ADAM17 verso l'apparato di Golgi per la maturazione, dove il precedente concetto di iRhom2 che fungeva semplicemente da "impalcatura passiva" è stato messo alla prova dalle strutture di Lee.
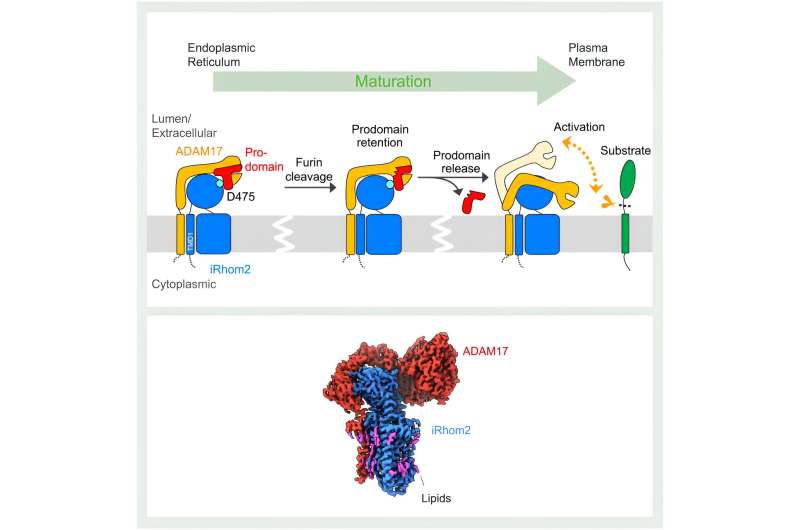
Si presumeva che l'interazione tra iRhom2 e ADAM17 avvenisse esclusivamente tra i domini transmembrana delle proteine, che fissano le proteine alla membrana cellulare. Con sorpresa dei ricercatori, le due proteine interagiscono anche attraverso le loro regioni extracellulari. Attraverso queste interazioni, iRhom2 mantiene un'importante regione di ADAM17 chiamata prodominio. Il prodominio è una regione che funge da spilla da balia su un estintore.
"ADAM17 stesso è autoinibito. Ha un limite di prodominio per bloccare il proprio sito di proteasi," ha spiegato Lee.
All'interno dell'apparato del Golgi, questo cappuccio del prodominio autoregolante viene tagliato. Tuttavia, iRhom2 mantiene il cappuccio ADAM17 finché il complesso non raggiunge la membrana cellulare. Questo passaggio è fondamentale per prevenire l'attivazione prematura di ADAM17. Le nuove strutture rivelano che una volta rimosso il cappuccio, ADAM17 viene attivato. Questa attivazione è contrassegnata da un significativo guadagno di flessibilità, che consente ad ADAM17 di cercare substrati nello spazio circostante.
È stato dimostrato che ADAM17 svolge un ruolo nello sviluppo e nella progressione di diversi tipi di cancro; tuttavia, la famiglia di proteine ADAM è ben conservata. Un farmaco che prende di mira ADAM17 può portare a effetti fuori bersaglio. Lee è ottimista sul fatto che le strutture possano offrire un modello per l'ingegnosità nella progettazione dei farmaci.
"Sulla base del nostro modello, se potessimo tenere insieme queste due proteine, ad esempio, attraverso un legante che migliora l'interazione tra iRhom2 e ADAM17, allora iRhom2 non rilascerà il cap del prodominio", ha affermato Lee. "Ciò ridurrà significativamente l'attività di ADAM17."
I primi autori dello studio sono Fangfang Lu, Università di Oxford e Hongtu Zhao, St. Jude. Gli altri autori corrispondenti dello studio sono Hongtu Zhao, St. Jude e Matthew Freeman, Università di Oxford. Gli autori aggiuntivi dello studio sono Yaxin Dai e Yingdi Wang, St. Jude.
Ulteriori informazioni: Fangfang Lu et al, Cryo-EM rivela che iRhom2 limita l'attività della proteasi ADAM17 per controllare il rilascio del fattore di crescita e dei segnali infiammatori, Cellula molecolare (2024). DOI:10.1016/j.molcel.2024.04.025
Informazioni sul giornale: Cellula molecolare
Fornito dal St. Jude Children's Research Hospital