I ricercatori guidati dal Prof. Zhang Zairong dell'Istituto di Chimica Organica di Shanghai dell'Accademia Cinese delle Scienze hanno identificato un percorso di topogenesi post-traduzionale per il ripiegamento e l'assemblaggio delle proteine di membrana multi-spanning (MSP).
Delle circa 5.000 proteine di membrana sintetizzate nella membrana del reticolo endoplasmatico (ER) delle cellule umane, più della metà sono MSP che svolgono ruoli critici nella fisiologia cellulare e dell'organismo, funzionando come canali ionici, trasportatori, recettori ed enzimi intramembrana.
Una parte significativa di queste funzioni si basa su amminoacidi polari e carichi, che portano alla formazione di TMD scarsamente idrofobici (pTMD). Tuttavia, i pTMD devono affrontare difficoltà per essere riconosciuti e integrati nel doppio strato fosfolipidico dal translocone Sec61, che preferisce i TMD idrofobici.
Nel proteoma umano, circa il 30% delle proteine di membrana e più del 50% delle MSP contengono almeno un pTMD. Il modo in cui questi pTMD vengono effettivamente identificati e confezionati con precisione in strutture MSP mature è stata una delle principali questioni scientifiche.
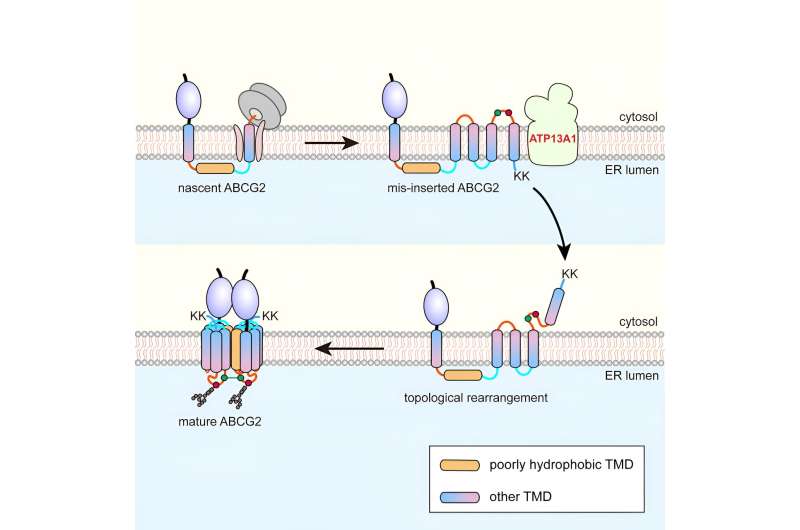
Utilizzando il trasportatore a cassetta legante l'adenosina trifosfato G2 (ABCG2) a sei strati come modello, i ricercatori hanno scoperto che durante la traslocazione co-traduzionale, pTMD2 di ABCG2 passa attraverso il poro centrale del traslocone nel lume dell'ER, anziché essere integrato nel il doppio strato fosfolipidico attraverso la porta laterale del translocone.
Ciò si traduce nell'inserimento di TMD a valle nella membrana ER con orientamenti inversi, formando così un intermedio unico. In seguito alla traslazione dei residui di lisina gemelli C-terminali caricati positivamente, si verifica un processo di riarrangiamento topologico quasi globale.
La purificazione di affinità ha mostrato che ATP13A1 può rilevare il segnale di carica positiva C-terminale di ABCG2. La sostituzione dei residui di lisina con amminoacidi carichi negativamente o neutri attenua significativamente le interazioni tra i mutanti ATP13A1 e ABCG2.
Inoltre, l'eliminazione di ATP13A1 ha provocato l'apparente accumulo di conformazioni ABCG2 mal ripiegate, principalmente quelle con TMD6 mal orientato all'interno della membrana ER. Pertanto, l'ATP13A1 svolge un ruolo cruciale nella topogenesi degli MSP, dove la sua attività ATPasi promuove la dislocazione del TMD6 mal orientato dal doppio strato lipidico nel citosol.
Successivamente, il TMD6 citosolico viene reintegrato nella membrana dell'ER, guidando così il riarrangiamento topologico post-traduzionale di altri TMD a monte.
Dopo il riarrangiamento riuscito dei TMD 4-6, l'intermedio può oligomerizzare in una struttura quaternaria. È probabile che questo processo faciliti l'integrazione di pTMD2 nella struttura finale dal lume acquoso del RE e nella struttura matura, che è strettamente avvolta dai TMD circostanti.
In sintesi, lo studio, ora pubblicato su Molecular Cell , spiega come un pTMD "difficile" viene saltato co-traduzionalmente per l'inserimento e sepolto post-traduzionalmente nella struttura finale corretta nella fase tardiva del ripiegamento, evitando così un'eccessiva esposizione ai lipidi.
In particolare, a causa dell'esposizione di pTMD2 al lume dell'ER durante la topogenesi di ABCG2, la modifica della glicosilazione N441 causata dalla mutazione genetica ABCG2-S441N può bloccare in modo significativo l'assemblaggio di pTMD nella fase avanzata della topogenesi. Poiché ABCG2 è un trasportatore dell'acido urico, questo studio spiega come questa mutazione sia strettamente associata a malattie umane come la gotta e l'iperuricemia.
Ulteriori informazioni: Jia Ji et al, Un percorso di topogenesi assistito da ATP13A1 per il ripiegamento di proteine di membrana multi-spanning, Cellula molecolare (2024). DOI:10.1016/j.molcel.2024.04.010
Informazioni sul giornale: Cellula molecolare
Fornito dall'Accademia cinese delle scienze