
Hanno giocato un ruolo chiave nel dimostrare il comportamento insolito del carbonio:Tim Schleif (a sinistra) e Joel Mieres Perez (a destra). Credito:RUB, Marquard
I chimici della Ruhr-Universität Bochum hanno trovato prove che gli atomi di carbonio non possono comportarsi solo come particelle, ma anche come onde. Questa proprietà quantomeccanica è ben nota per le particelle leggere come gli elettroni o gli atomi di idrogeno. Però, i ricercatori hanno osservato solo raramente la dualità onda-particella per gli atomi pesanti, come il carbonio. Il team guidato dal Prof. Dr. Wolfram Sander e Tim Schleif della Cattedra di Chimica Organica II insieme al Prof. Dr. Weston Thatcher Borden, Università del Texas settentrionale, rapporti sul giornale Angewandte Chemie .
"Il nostro risultato è uno dei pochi esempi che mostrano che gli atomi di carbonio possono mostrare effetti quantistici, " dice Sander. Nello specifico, i ricercatori hanno osservato che gli atomi di carbonio possono creare tunnel. Superano così una barriera energetica, anche se in realtà non possiedono abbastanza energia per farlo.
Raramente osservato per particelle pesanti
Wolfram Sander spiega il paradosso:"È come se una tigre avesse lasciato la sua gabbia senza saltare oltre il recinto, che è troppo alto per lui. Ma esce comunque." Questo è possibile solo se si comporta come un'onda, ma non se si comporta come una particella. La probabilità che un oggetto possa scavare un tunnel dipende dalla sua massa. Il fenomeno può, ad esempio, essere osservato molto più facilmente per gli elettroni leggeri che per gli atomi di carbonio relativamente pesanti.
I ricercatori hanno studiato la reazione del tunnel utilizzando il riarrangiamento di Cope, una reazione chimica nota da quasi 80 anni. Il materiale di partenza per la reazione, un composto idrocarburico, è identico alla molecola del prodotto. Lo stesso composto chimico esiste quindi prima e dopo la reazione. Però, i legami tra gli atomi di carbonio cambiano durante il processo.
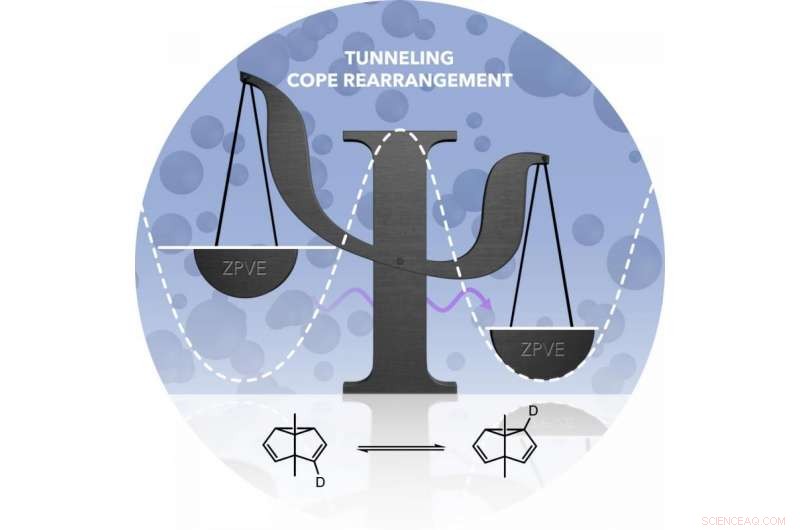
Il riarrangiamento di Cope si traduce in un prodotto identico al materiale di partenza. Però, entrambe le forme hanno energie diverse. La barriera energetica per il riassetto (simboleggiata dalla linea tratteggiata) non può essere superata a basse temperature. Solo quando l'atomo di carbonio si comporta come un'onda (freccia viola) può aggirare la barriera. Credito:Markus Henkel
Nel loro esperimento, i ricercatori di Bochum hanno segnato uno degli atomi di carbonio nella molecola:hanno sostituito l'atomo di idrogeno ad esso legato con l'isotopo di idrogeno deuterio, una versione più pesante dell'idrogeno. Le molecole prima e dopo il riarrangiamento di Cope differivano in termini di distribuzione del deuterio. A causa di queste diverse distribuzioni, entrambe le forme molecolari avevano energie leggermente diverse.
La reazione non dovrebbe effettivamente aver luogo
A temperatura ambiente, questa differenza ha scarso effetto; grazie all'abbondante apporto di energia termica nell'area circostante, entrambe le forme si verificano con la stessa frequenza. Però, a temperature molto basse sotto i dieci Kelvin, una forma molecolare è significativamente preferita a causa della differenza di energia. Quando si passa dalla temperatura ambiente a temperature estremamente basse, l'equilibrio deve passare da una distribuzione equa di entrambe le forme a una distribuzione ineguale.
Questo passaggio non può, però, avvengono nel modo classico – poiché, quando si riordina da una forma all'altra, una barriera energetica deve essere superata, anche se la molecola stessa non ha l'energia per questo e anche l'ambiente freddo non è in grado di fornirla. Sebbene il nuovo equilibrio non dovrebbe avvenire nel modo classico, i ricercatori sono stati comunque in grado di dimostrarlo nell'esperimento. La loro conclusione:il riarrangiamento di Cope a temperature estremamente basse può essere spiegato solo da un effetto tunnel. Hanno quindi fornito prove sperimentali per una previsione fatta da Weston Borden più di cinque anni fa sulla base di studi teorici.
I solventi influenzano la capacità di tunneling
Alla Ruhr-Universität, Wolfram Sander intraprende la ricerca nel cluster di eccellenza Ruhr Explores Solvation, dove si occupa delle interazioni di solventi e molecole disciolte. "È noto che i solventi influenzano la capacità di tunneling, " dice il chimico. "Tuttavia, finora non è stato capito come lo fanno."