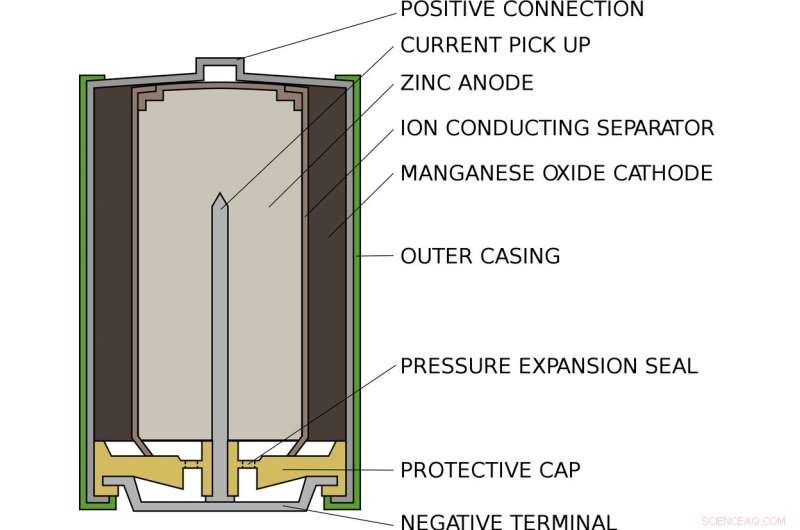
Che aspetto ha una batteria alcalina AA standard all'interno. Credito:titolare del lead/Wikimedia Commons
L'era degli smartphone ha solo poco più di un decennio, ma i computer tascabili al centro di quella trasformazione della società sono davvero possibili solo grazie a un'altra tecnologia:le batterie agli ioni di litio.
Venduto commercialmente per la prima volta nel 1991 da Sony per le sue videocamere, questi tipi di batterie vanno bene per molto di più dell'elettronica di consumo portatile. Sono al centro di altre due rivoluzioni tecnologiche con il potere di trasformare la società:il passaggio dai motori a combustione interna ai veicoli elettrici, e il passaggio da una rete elettrica alimentata da combustibili fossili a generatori di energia rinnovabile che immagazzinano l'elettricità in eccesso nelle batterie per un uso futuro.
Quindi come funzionano queste batterie? Scienziati e ingegneri hanno trascorso intere carriere cercando di costruire batterie migliori e ci sono ancora misteri che non comprendiamo appieno. Il miglioramento delle batterie richiede che chimici e fisici osservino i cambiamenti a livello atomico, così come ingegneri meccanici ed elettrici che possono progettare e assemblare i pacchi batteria che alimentano i dispositivi. Come scienziato dei materiali presso l'Università di Washington e il Pacific Northwest National Lab, il mio lavoro ha aiutato a esplorare nuovi materiali per le batterie al litio-aria, batterie al magnesio e, naturalmente, batterie agli ioni di litio.
Consideriamo un giorno nella vita di due elettroni. Chiameremo uno di loro Alex e ha un amico di nome George.
Anatomia della batteria
Alex vive all'interno di una normale batteria alcalina AA, come nella torcia o nel telecomando. All'interno di una batteria AA, c'è un compartimento pieno di zinco e un altro pieno di ossido di manganese. Ad un'estremità, lo zinco si attacca solo debolmente agli elettroni come Alex. Dall'altra parte, l'ossido di manganese attira potentemente gli elettroni verso se stesso. Nel mezzo, impedendo agli elettroni di andare direttamente da un lato all'altro, è un pezzo di carta imbevuto di una soluzione di potassio e acqua, che coesistono come ioni potassio positivi e ioni idrossido negativi.
Quando la batteria viene inserita in un dispositivo e accesa, il circuito interno del dispositivo è completato. Alex viene tirato fuori dallo zinco, attraverso il circuito e nell'ossido di manganese. Lungo la strada, il suo movimento alimenta il dispositivo, o lampadina o qualunque cosa sia collegata alla batteria. Quando Alex se ne va, non può tornare indietro:lo zinco che ha perso un elettrone si lega all'idrossido per formare ossido di zinco. Questo composto è estremamente stabile e non può essere facilmente riconvertito in zinco.
Dall'altro lato della batteria, l'ossido di manganese guadagna un atomo di ossigeno dall'acqua e lascia ioni idrossido per bilanciare l'idrossido consumato dallo zinco. Una volta che tutti i vicini di Alex hanno lasciato lo zinco e si sono trasferiti all'ossido di manganese, la batteria è esaurita e deve essere riciclata.
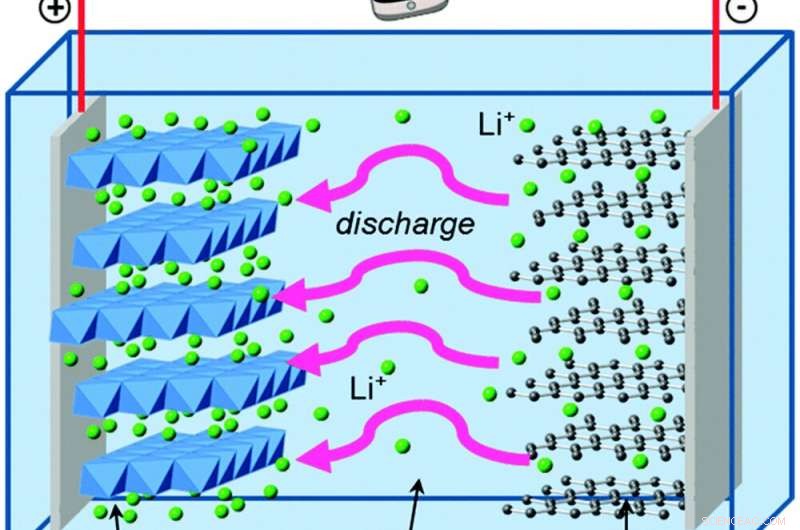
Quando gli elettroni si spostano all'esterno della batteria, gli ioni di litio si muovono al suo interno per mantenere l'equilibrio elettrico. Credito:Islam e Fisher, Recensioni Società Chimica, 2014, CC BY
Vantaggi agli ioni di litio
Confrontiamolo con George, che vive in una batteria agli ioni di litio. Le batterie agli ioni di litio hanno gli stessi elementi costitutivi di base delle celle AA alcaline, con alcune differenze che conferiscono grandi vantaggi.
George vive nella grafite, che è ancora più debole dello zinco nel trattenere gli elettroni. E l'altra parte della sua batteria è ossido di litio e cobalto, che attira gli elettroni molto più potentemente dell'ossido di manganese, il che dà alla sua batteria la capacità di immagazzinare molta più energia nella stessa quantità di spazio di una batteria alcalina. La soluzione che separa la grafite e l'ossido di cobalto di litio contiene ioni di litio carichi positivamente, che formano e rompono facilmente i legami chimici quando la batteria viene scaricata e ricaricata.
Queste reazioni chimiche sono reversibili, a differenza della formazione di ossido di zinco, che è ciò che consente agli elettroni e agli ioni di litio di fluire avanti e indietro per molti cicli di carica e scarica.
Questo processo non è efficiente al 100%, tuttavia, tutte le batterie alla fine perdono la capacità di trattenere energia. Tuttavia, la famiglia delle sostanze chimiche agli ioni di litio è stata abbastanza potente da dominare la tecnologia delle batterie oggi.
Questo articolo è stato ripubblicato da The Conversation con una licenza Creative Commons. Leggi l'articolo originale. 