È noto che il malfunzionamento delle proteine FLVCR1 e FLVCR2 porta a rare malattie ereditarie nell'uomo che causano disturbi motori, sensoriali e neurologici. Tuttavia, i meccanismi biochimici alla base di ciò e le funzioni fisiologiche delle proteine FLVCR non sono ancora chiari.
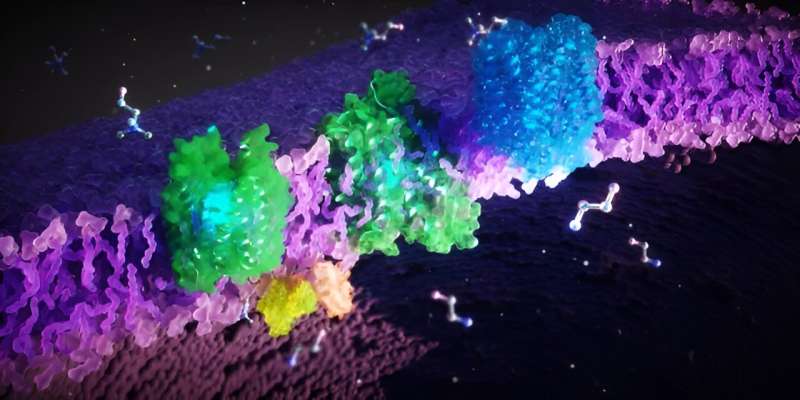
Un team interdisciplinare di ricercatori provenienti da Francoforte sul Meno, Singapore e dagli Stati Uniti ha ora decifrato le strutture 3D delle proteine FLVCR e le loro funzioni cellulari. I ricercatori hanno dimostrato che le proteine trasportano i mattoni cellulari colina ed etanolamina. Le loro scoperte contribuiscono in modo significativo alla comprensione della patogenesi delle malattie rare e allo sviluppo di nuove terapie.
Nelle serie TV ospedaliere, i medici cercano diagnosi corrette e possibili trattamenti per pazienti con sintomi a volte sconcertanti o strani. In realtà, questo processo spesso richiede anni per le persone affette da malattie rare. In molti casi non esistono farmaci efficaci e le opzioni terapeutiche sono limitate.
Circa il 6%–8% della popolazione mondiale soffre di una malattia rara. Si tratta di circa 500 milioni di persone, anche se ciascuna delle oltre 7.000 malattie diverse colpisce solo circa 1 persona su 2.000. Poiché queste malattie sono così rare, la conoscenza medica e scientifica su di esse è limitata. Ci sono solo pochi esperti in tutto il mondo e manca una consapevolezza sociale.
Un team internazionale di ricercatori guidato da Schara Safarian, capogruppo di progetto presso l'Istituto di biofisica Max Planck nonché capogruppo indipendente presso l'Istituto Fraunhofer di medicina traslazionale e farmacologia ITMP, e l'Istituto di farmacologia clinica dell'Università Goethe di Francoforte, ha ora ha studiato la struttura e la funzione cellulare di due proteine, FLVCR1 e FLVCR2, che svolgono un ruolo causale in una serie di malattie ereditarie rare.
Gli scienziati hanno pubblicato le loro scoperte su Nature .
Malfunzionamenti di FLVCR1 e FLVCR2 dovuti a mutazioni genetiche causano malattie rare, alcune delle quali provocano gravi disturbi visivi, motori e sensoriali, come l'atassia della colonna posteriore con retinite pigmentosa, la sindrome di Fowler o neuropatie sensoriali e autonomiche. Quest'ultimo può, ad esempio, portare ad una completa perdita della sensazione di dolore.
"In molte malattie, comprese quelle rare, le strutture cellulari del nostro corpo vengono alterate e questo porta a malfunzionamenti nei processi biochimici", afferma Schara Safarian. "Per comprendere lo sviluppo di tali malattie e sviluppare terapie, dobbiamo sapere come sono strutturate queste proteine a livello molecolare e quali funzioni svolgono nelle cellule sane."
Gli scienziati hanno scoperto che FLVCR 1 e FLVCR2 trasportano le molecole colina ed etanolamina attraverso le membrane delle nostre cellule. "La colina e l'etanolamina sono essenziali per importanti funzioni corporee. Supportano la crescita, la rigenerazione e la stabilità delle nostre cellule, ad esempio nei muscoli, negli organi interni e nel cervello", spiega Safarian.
"Inoltre, la colina è coinvolta nel metabolismo dei grassi e nella disintossicazione del fegato. Il nostro corpo ne ha bisogno anche per produrre il neurotrasmettitore acetilcolina, che è fondamentale per il nostro sistema nervoso ed è necessario al nostro cervello per controllare gli organi. Quindi potete immaginare che i malfunzionamenti delle proteine FLVCR può causare gravi disturbi neurologici e muscolari."
I ricercatori hanno utilizzato metodi microscopici, biochimici e assistiti da computer per studiare le proteine FLVCR. "Abbiamo congelato le proteine e poi le abbiamo osservate al microscopio elettronico", spiega Di Wu, ricercatore presso l'Istituto di biofisica Max Planck e coautore dello studio. "Un fascio di elettroni penetra nel campione congelato e l'interazione degli elettroni con il materiale crea un'immagine."
I ricercatori prendono molte immagini individuali, le elaborano e le combinano computazionalmente per ottenere strutture 3D di proteine ad alta risoluzione. In questo modo, hanno potuto decifrare le strutture di FLVCR1 e FLVCR2 e vedere come cambiano in presenza di etanolamina e colina. Le simulazioni al computer hanno confermato e visualizzato il modo in cui le proteine FLVCR interagiscono con l'etanolamina e la colina e modificano dinamicamente la loro struttura per consentire il trasporto dei nutrienti.
Safarian riassume:"I nostri risultati aprono la strada alla comprensione dello sviluppo e della progressione delle malattie rare associate alle proteine FLVCR. In futuro, i pazienti potrebbero beneficiare di nuove terapie che ripristinano la qualità della loro vita."
Ulteriori informazioni: Keiken Ri et al, Meccanismo molecolare del trasporto di colina ed etanolamina negli esseri umani, Natura (2024). DOI:10.1038/s41586-024-07444-7
Informazioni sul giornale: Natura
Fornito dalla Max Planck Society