Sin dalla loro scoperta, i ricercatori hanno ripetutamente dimostrato le potenziali applicazioni mediche di cellule e tessuti differenziati generati da cellule staminali pluripotenti indotte (iPS). Tuttavia, un ostacolo significativo alle applicazioni mediche nel mondo reale è legato al substrato utilizzato per coltivare e indurre le cellule iPS in tipi cellulari differenziati.
In particolare, sebbene siano stati segnalati protocolli di differenziazione che generano miociti e cellule staminali muscolari (MuSC) da cellule iPS, rimangono relativamente bassi in termini di efficienza e richiedono l'uso di un popolare substrato di derivazione animale chiamato Matrigel.
Per andare avanti, sono necessari protocolli di induzione più efficienti e uno spostamento verso substrati privi di xeno (senza prodotti di derivazione animale) in grado di garantire efficacia in termini di costi, riproducibilità e sicurezza.
A tal fine, un team giapponese ha unito le proprie competenze per progettare e convalidare una nuova proteina ricombinante della matrice extracellulare, denominata frammenti di laminina di nuova generazione (NGLF), per differenziare le cellule iPS in lignaggi di cellule muscolari.
I risultati di questo studio sono stati pubblicati su Advanced Science il 29 aprile 2024.
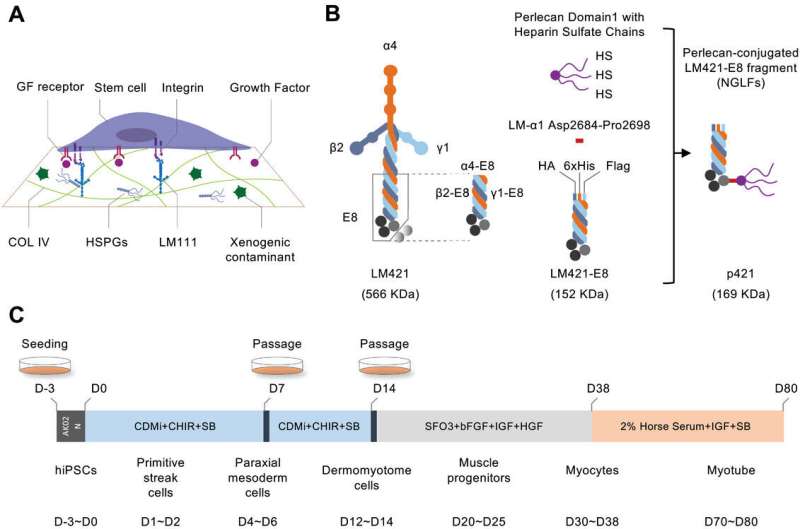
Studi precedenti hanno stabilito frammenti di laminina ricombinante E8 (LM-E8) come substrato minimo per colture cellulari iPS, ma non supportano la differenziazione miogenica. Per identificare una variante LM-E8 in grado di supportare la generazione di miociti e MuSC da cellule iPS, il team ha testato varie laminine con composizioni diverse, ma ha scoperto che supportavano solo livelli drasticamente inferiori di differenziazione miogenica.
I ricercatori hanno ritenuto che il perlecano, un nucleo multifunzionale di eparan solfato proteoglicano (HSPG) con catene multiple di eparan solfato contenuto in Matrigel, possa essere vitale per la sua capacità di supportare varie interazioni molecolari necessarie per il mantenimento e la differenziazione ottimali delle cellule iPS e hanno quindi progettato un LM-E8 collegato al dominio perlecano 1 con tre catene HS (D1-HS).
I ricercatori hanno osservato miglioramenti significativi nella differenziazione miogenica collegando questa modifica al C-terminale delle varianti LM-E8. In particolare, l'isoforma p421 ha mostrato il miglioramento migliore, addirittura migliore di Matrigel, quindi i ricercatori si sono concentrati sull'utilizzo di questa isoforma per generare miociti e MuSC.
Esaminando i marcatori di differenziazione in vari stadi (vale a dire, striscia primitiva (PS), mesoderma parassiale (PM) e dermomiotomo (DM)), il gruppo di ricerca ha confermato che non solo gli NGLF sono superiori alle corrispondenti varianti LM-E8 nel promuovere fasi specifiche espressione del gene marcatore, p421 supporta costantemente una migliore differenziazione rispetto a qualsiasi altro NGLF testato.
In particolare, i ricercatori hanno scoperto che p421 supporta specificamente la differenziazione allo stadio PM, poiché non sono stati osservati effetti benefici da p421 in seguito alla formazione di PM. Inoltre, utilizzando l'eparitinasi (per degradare le catene HS) e il surfen (per inibire le interazioni mediate dall'HS), hanno dedotto che gli effetti benefici di p421 derivano principalmente dalla porzione HS.
Inoltre, bloccando molteplici recettori di segnalazione e i loro effettori intracellulari a valle, hanno determinato che p421 funziona principalmente attraverso la via bFGF-FGFR-EGF per promuovere l'induzione di PM. L'analisi dell'espressione genica ha inoltre indicato che questa segnalazione supportava l'espressione del gene HOX per promuovere le cellule iPS indifferenziate verso lo stadio PS.
Per dimostrare l'importanza dell'orientamento della coniugazione tra LM-E8 e D1-HS, i ricercatori hanno generato varianti p421 attaccando la porzione HS all'estremità N-terminale della catena β o γ di LM-E8. Sebbene queste varianti abbiano aumentato l'espressione del gene marcatore specifico per lo stadio, p421 ha mostrato effetti sostanzialmente più forti in confronto.
Da questi risultati, il gruppo di ricerca ha concluso che p421 probabilmente aiuta la segnalazione dell'FGFR avvicinando gli FGF legati all'HS alla superficie cellulare per promuovere la dimerizzazione dell'FGFR.
Infine, per illustrare come p421 migliora la differenziazione miogenica e supera le incoerenze che affliggono gli attuali protocolli di induzione, il team di ricerca ha generato linee cellulari iPS di malattia e di controllo per due forme di distrofia muscolare, la distrofia muscolare di Duchene (DMD) e la miopatia di Miyoshi (MM).
Come previsto, p421 ha supportato una differenziazione miogenica notevolmente migliorata da tutte le linee cellulari iPS esaminate. Inoltre, i ricercatori hanno scoperto che p421 migliora la differenziazione miogenica in diversi terreni di coltura comunemente utilizzati.
In sintesi, il team di ricerca ha creato con successo un substrato proteoglicano ricombinante che supporta miglioramenti significativi nella differenziazione miogenica e ne ha dimostrato il meccanismo sottostante.
Si spera che gli NGLF contribuiscano a stabilire protocolli di differenziazione altamente efficienti e privi di xeno per generare lignaggi di cellule muscolari derivate da cellule iPS per applicazioni mediche contro varie miopatie.
Ulteriori informazioni: Mingming Zhao et al, I frammenti di laminina-E8 coniugati con catena di eparan solfato fanno avanzare la differenziazione mesodermica parassiale seguita da un'elevata induzione miogenica da hiPSC, Scienza avanzata (2024). DOI:10.1002/advs.202308306
Informazioni sul giornale: Scienza avanzata
Fornito dall'Università di Kyoto