I biologi della Monash University hanno fatto luce sugli intricati meccanismi molecolari responsabili del silenziamento genico indotto dalle ripetizioni espanse in uno studio internazionale pubblicato oggi su Nature Plants .
Questo fenomeno è stato collegato a una serie di malattie ereditarie, tra cui l'atassia di Friedreich negli esseri umani, e causa anomalie della crescita in piante come l'Arabidopsis thaliana.
La ricerca mirava a comprendere il meccanismo mediante il quale le ripetizioni allargate causano il silenziamento epigenetico, una procedura essenziale per il controllo dell'espressione genica.
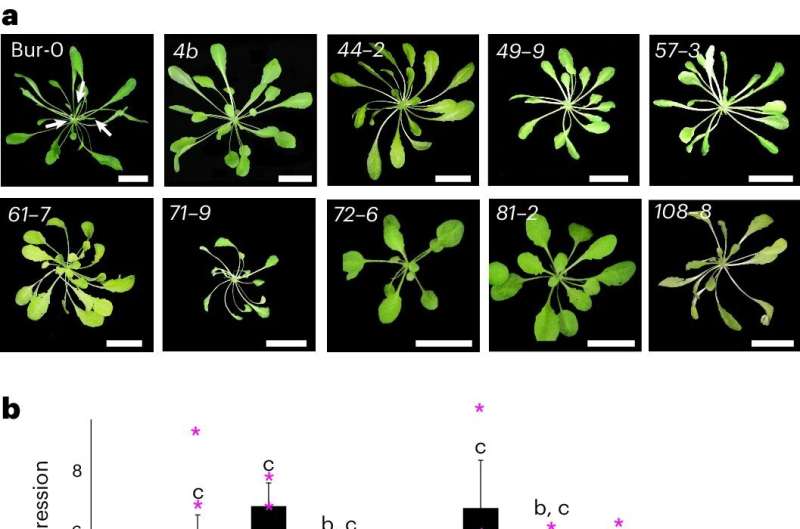
I ricercatori hanno scoperto nuovi componenti necessari per questo processo di silenziamento utilizzando un modello di pianta che presenta i sintomi di difetti di crescita a temperature più elevate ma non a temperature più basse.
Secondo lo studio, la proteasi SUMO FUG1, il lettore di istoni AL3 e la proteina del cromodominio LHP1 sono stati identificati come i tre attori più importanti.
"Queste proteine si uniscono per creare un modulo essenziale richiesto per il silenziamento epigenetico indotto dall'espansione ripetuta", ha affermato l'autore principale dello studio, il dottor Sridevi Sureshkumar, che dirige la genetica presso il Core Research Group presso la Monash University School of Biological Sciences.
"La nostra ricerca rivela il ruolo cruciale che queste proteine svolgono nell'orchestrare il silenziamento genetico attivato dalle ripetizioni espanse", ha affermato il dott. Sureshkumar.
"La conoscenza di questi sistemi non solo contribuisce al progresso della nostra comprensione della biologia vegetale, ma offre anche approfondimenti sulle malattie che colpiscono gli esseri umani", ha affermato.
Nel corso della ricerca sono stati utilizzati moderni metodi di screening genetico e test sui due ibridi sul lievito per determinare che FUG1, una proteasi SUMO non caratterizzata, partecipa in modo significativo al silenziamento epigenetico. Dopo ulteriori analisi, è stato dimostrato che FUG1 interagisce con AL3, che è un lettore di istoni noto per legarsi a particolari segni istonici correlati all'espressione genica efficace.
Inoltre, i ricercatori hanno scoperto che la proteina AL3 interagisce con LHP1, che è una proteina del dominio cromosomico che svolge un ruolo nella diffusione dei segni istonici restrittivi. L'inversione del silenziamento genico e la soppressione dei sintomi associati all'espansione ripetuta sono state entrambe provocate dalla perdita di funzione di uno qualsiasi di questi componenti durante l'esperimento.
"Questi risultati evidenziano l'importanza dei modificatori post-traduzionali e dei lettori di istoni nella regolazione epigenetica", ha affermato il dott. Sureshkumar.
"Il nostro studio apre la strada a ulteriori ricerche sul ruolo di queste proteine in vari processi biologici e malattie umane", ha affermato.
"I risultati non solo presentano potenziali conseguenze per la salute umana, ma contribuiscono anche alla nostra comprensione della biologia vegetale, che è già avanzata."
Il dottor Sureshkumar, che ha condotto questo studio internazionale che ha coinvolto istituzioni nel Regno Unito, Cina, Canada, India e Australia, ha affermato che la collaborazione multinazionale li ha aiutati a fare progressi in diversi aspetti di questa ricerca.
Il dottor Sureshkumar ha affermato che questa ricerca potrebbe potenzialmente rappresentare un percorso per lo sviluppo di nuove tecniche terapeutiche che mirano alla disregolazione epigenetica nelle persone che soffrono di malattie ereditarie.
Ulteriori informazioni: Sridevi Sureshkumar et al, la proteasi SUMO FUG1, il lettore di istoni AL3 e la proteina del cromodominio LHP1 sono parte integrante della ripetizione del silenziamento genico indotto dall'espansione in Arabidopsis thaliana, Piante naturali (2024). DOI:10.1038/s41477-024-01672-5
Informazioni sul giornale: Piante naturali
Fornito dalla Monash University