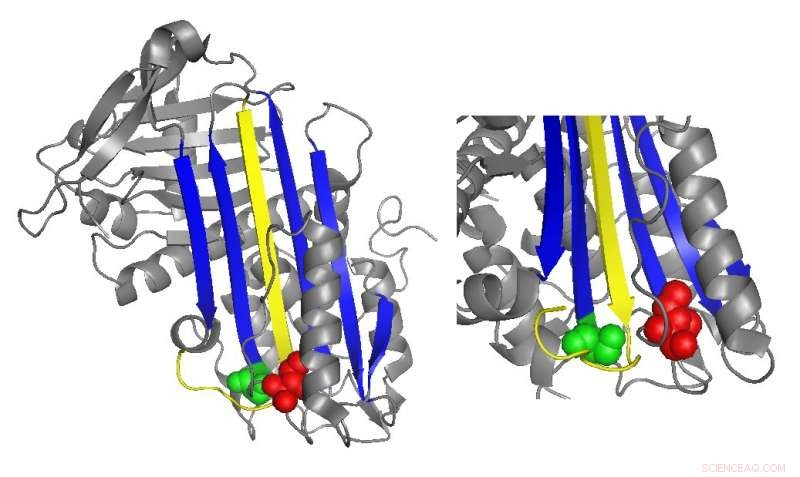
Un diagramma a nastro dell'antitrombina evidenzia le posizioni delle mutazioni funzionalmente importanti. Credito:Irene Martinez-Martinez
Quando una persona è ferita, la coagulazione del sangue è essenziale. Però, una volta passato il pericolo, è altrettanto essenziale arrestare la risposta della coagulazione per prevenire la trombosi, o l'ostruzione del flusso sanguigno da coaguli. Una proteina chiamata antitrombina è responsabile dell'arresto della coagulazione, ma circa una persona su duemila ha una carenza ereditaria di antitrombina che le espone a un rischio molto più elevato di coaguli di sangue potenzialmente letali.
Un gruppo di ricercatori in Spagna ha analizzato le mutazioni nelle proteine dell'antitrombina di questi pazienti e ha scoperto che una parte della proteina svolge un ruolo inaspettato nella sua funzione. Questa comprensione di come funziona l'antitrombina potrebbe portare a trattamenti non solo per i pazienti con deficit di antitrombina, ma anche a farmaci meglio progettati per altre malattie del sangue. La ricerca sarà pubblicata nel numero del 6 ottobre del Journal of Biological Chemistry .
Il Centro Regional de Hemodonacion e Hospital Universitario Morales Meseguer dell'Universidad de Murcia in Spagna è un centro di riferimento per la diagnosi del deficit di antitrombina. Da oltre 15 anni, i ricercatori del laboratorio hanno ricevuto campioni da pazienti con diverse mutazioni che influenzano il funzionamento della loro antitrombina.
L'antitrombina normalmente inibisce la trombina inserendo una regione a forma di anello, chiamato anello centrale reattivo, nel sito attivo della proteina trombina, impedendo alla trombina di catalizzare la formazione di coaguli distorcendo la forma del sito attivo della trombina. Molte mutazioni dell'antitrombina che causano malattie della coagulazione colpiscono direttamente o indirettamente il ciclo del centro reattivo. Però, studi biochimici condotti da Irene Martinez-Martinez hanno scoperto che anche le mutazioni in una parte completamente diversa dell'antitrombina hanno contribuito alla sua disfunzione.
"Abbiamo visto che [avevamo] mutanti che stavano influenzando la funzione della proteina anche se erano molto lontani dalla parte principale della proteina responsabile dell'inibizione, " Martinez-Martinez ha detto. "La gente pensava che la funzione dell'antitrombina fosse principalmente focalizzata su un dominio della proteina. Con questo lavoro, abbiamo capito che non è vero".
Le analisi dei ricercatori delle nuove mutazioni hanno suggerito che il dominio dell'antitrombina all'estremità opposta del ciclo del centro reattivo aiuta a mantenere la trombina intrappolata nella sua fase finale, forma distorta. Quando c'erano mutazioni specifiche in questa regione, la trombina era più spesso in grado di tornare alla sua forma attiva e degradare e rilasciare l'antitrombina.
Martinez-Martinez spera che la comprensione dell'importanza di questa regione dell'antitrombina possa portare a farmaci migliori per prevenire la coagulazione del sangue attivando l'antitrombina o prevenire il sanguinamento inibendolo. Sottolinea inoltre che la natura essenziale di questo dominio della proteina non avrebbe potuto essere prevista semplicemente studiando le sequenze di antitrombine sane.
"Questo lavoro è stato possibile grazie alla caratterizzazione delle mutazioni identificate nei pazienti, "Ha detto Martinez-Martinez.
Il lavoro è stato finanziato dalle fondazioni Instituto de Salud Carlos III e FEDER, nonché dalla Fundación Séneca.