Astratto grafico. Credito:Cellula molecolare (2022). DOI:10.1016/j.molcel.2022.06.024
Pubblicato nella Cellula molecolare giornale del 19 luglio, uno studio di ricerca dell'Hatters Laboratory ha mostrato che l'aggregazione proteica inappropriata è collegata a scarsi risultati per la salute e la sopravvivenza delle cellule, specialmente nei neuroni nelle malattie neurodegenerative.
Lo studio ha studiato le forze motrici molecolari che causano l'adesione anormale delle proteine mal ripiegate e ha esaminato l'impatto delle proteine appiccicose sulle proteine circostanti in una cellula, in particolare il modo in cui i sistemi di proteostasi rilevano queste proteine appiccicose per impedirne l'aggregazione.
La ricerca è il risultato di una collaborazione tra il professor Rohit Pappu della Washington University, i ricercatori dell'Università di Melbourne, incluso il dottorato di ricerca. studente e primo autore uguale, Yoon Hee Choi, il professor David Ascher, il dottor Dezerae Cox e Angelique Haynes e ricercatori dell'Università di Leeds.
"Abbiamo scoperto che c'erano particolari proteine che normalmente regolano il ripiegamento delle proteine, chiamate chaperone molecolari, che sono molto specifiche per rilevare particolari modelli di adesivi. Questa è una scoperta importante poiché informa il modo in cui le cellule rilevano quando le proteine si aggregano in modo anomalo", ha affermato il professor Hatters.
Le proteine sono fondamentali per il funzionamento delle cellule e la sopravvivenza cellulare e la proliferazione richiede che le proteine si pieghino e leghino altre proteine.
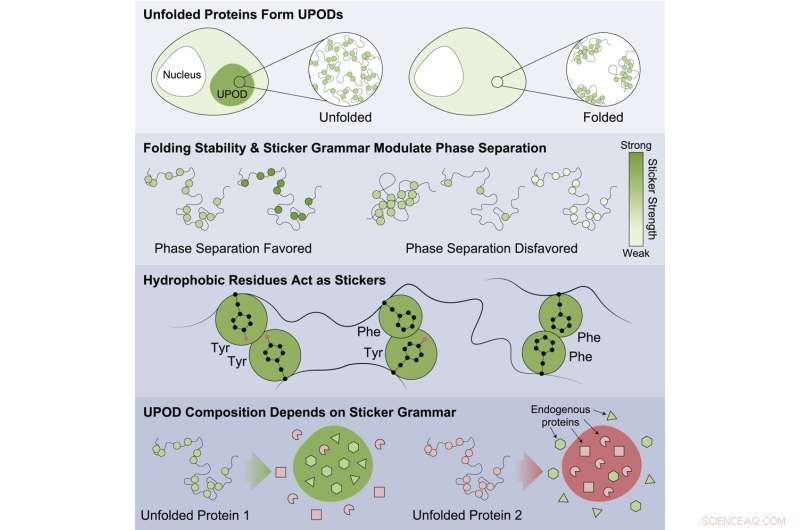
"Quando le proteine non si ripiegano correttamente, le forme intermedie 'mal ripiegate', note come depositi proteici non ripiegati (UPOD), possono aderire in aggregati. Tali aggregati si verificano in molti contesti patologici, quando i sistemi molecolari che regolano il ripiegamento delle proteine e la eliminazione della proteostasi ' abbattere", ha detto Choi.
Lo studio ha evidenziato che le proteine meno stabili avevano maggiori probabilità di aggregarsi e di essere associate alla malattia. I risultati suggeriscono che ciò avvenga attraverso l'aggregazione inappropriata di forme ripiegate in modo errato con diverse subunità che rilevano diversi codici "adesivi" che dirigono l'aggregazione. Le proteine sono coinvolte in un gran numero di malattie tra cui tumori, disturbi congeniti, malattie del sistema nervoso, disturbi del metabolismo e malattie della pelle.
Sono stati trovati modelli specifici di adesivi che erano importanti per dirigere l'aggregazione e che causavano la co-aggregazione di altre proteine circostanti nella cellula. Il lavoro ha mostrato che alcune classi di aminoacidi erano i migliori adesivi (tirosina e fenilalanina) e che il modello degli aminoacidi era importante per il modo in cui le proteine degli astanti venivano co-aggregate in modo inappropriato e il modo in cui gli accompagnatori molecolari riconoscevano gli aggregati che si formavano.
"Il prossimo passo è capire meglio i meccanismi di questo. Questo potrebbe essere utile negli sforzi futuri per riprogrammare le cellule per eliminare meglio gli aggregati proteici, come nelle malattie in cui si accumulano ampiamente", ha affermato il professor Hatters.